I.
FEED DAN PRODUK
a.
Feed Steam Cracking
Umpan utama steam cracking adalah LPG (C3H8+C4H10) dan
NGL (C2H6, LPG, light naphta).
a.
Produk Steam Cracking
i.
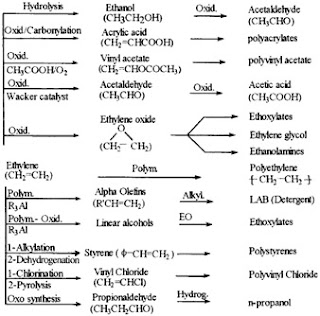
Etilena
Etilena merupakan salah satu senyawa hidrokarbon yang
juga sering disebut dengan “king of petrochemicals” karena sebagian besar
senyawa kimia komersial dihasilkan dari etilena dibandingkan dari produk
intermediet yang lain. Kedudukan etilena yang unik ini dibandingkan dengan
senyawa hidrokarbon lainnya karena karakteristik molekulnya baik dari segi
teknis maupun segi ekonomis. Karakteristik molekul tersebut antara lain:
1.
Struktur sederhana
dengan reaktivitas yang tinggi
2.
Senyawa yang relatif
murah
3.
Dapat diproduksi
dengan mudah melalui proses steam cracking dengan hasil (yield) yang tinggi
Etilena dihasilkan dengan mereaksikan beberapa
reagen yang murah seperti air, chlorin, hydrogen chlorine, dan oksigen untuk
menghasilkan senyawa yang lebih bernilai. Reaksi pembuatan etilena ini dapat
dimulai dari radikal bebas atau dengan katalis untuk menghasilkan polyethylene,
polimer termoplastis dengan volume
terbesar. Etilena ini juga dapat berkopolimerisasi dengan olefin yang lain untuk
menghasilkan polimer dengan properties yang lebih unggul. Sebagai contoh
etilena berkopolimerisasi dengan propilena menghasilkan elastomer yang bersifat
termoplastis. Berikut ini persenyawaan penting yang dapat terjadi dengan
senyawa etilena.
a. Sifat-sifat Fisis
b.
Sifat Kimia
1. Reaksi
Polimerisasi
Ethylene dengan kemurnian
99,9% dapat dipolimerisasi pada tekanan dan temperatur dengan
menggunakan
katalis tertentu.
n(CH2=CH2)
Reaksi
polimerisasi ethylene bersifat eksotermis, menggunakan dua jenis
inisiator yaitu inisiator
homogen
(radikal atau kation) dan inisiator. heterogen (katalis padat). Polimerisasi
ini dapat dijalankan dengan dua sistem :
-
Polimerisasi
pada tekanan tinggi (60-350 Mpa
dan 300°C)
dengan inisiator radikal (oksigen, peroksida) menghasilkan LDPE (0,910-0,940
g/ml).
-
Polimerisasi
pada tekanan rendah (0,1-20 Mpa
dan 50-300°C)
dengan katalisator heterogen (oksida logam transisi pada pembawa
anorganik).
Polimerisasi ini menghasilkan HDPE (0,941- 0,970 g/ml).
2. Reaksi
Oksidasi
Oksidasi terhadap ethylene akan menghasilkan
senyawa-senyawa ethylene oksida, ethylene glikol, asetaldehida atau senyawa
vinyl asetat. Ethylene oksida/glikol dapat dihasilkan oksidasi ethylene fase
uap secara langsung melalui katalis perak oksida pada 200-300°C dan tekanan
1,5-3,0 Mpa. Improvisasi proses pembuatan ethylene glikol untuk mencegah
pembentukan ethylene oksida dapat dilakukan melalui oksidasi ethylene menjadi
ethylene glikol mono dan di-asetat dengan katalis telurrium, kemudian
dihidrolisa.
4CH2=CH2+6CH3COOH+2O2→2CH3COOCH2CH2OH+2CH2COOCH2CH2COOCH3
2CH3COOCH2CH2OH+2CH2COOCH2CH2COOCH3+6H2O→4HOCH2CH2OH+
CH3COOH
Oksidasi langsung terhadap ethylene dengan katalis
paladium klorida akan dihasilkan asetaldehida.
CH2=CH2 + ½ O2 →
CH3CHO
3. Reaksi Addisi
Beberapa reaksi addisi ethylene yang penting dapat
ditunjukkan pada tabel berikut ini :
Tabel 1.3. Reaksi Addisi dari Ethylene
4. Reaksi dengan
Benzene
Jika ethylene dipanaskan dengan benzene pada
temperatur 925°C akan terbentuk ethracen.
2C6H6 + C2H4 ↔C4H10
+ 3H2
5. Reaksi -
reaksi lain
Reaksi alkylasi ethylene dengan parafin akan
memberikan parafin rantai cabang, seperti dimethyl butana dari alkylasi
ethylene dengan isobutana pada suhu 60°C dan katalis AlCl3 dan promotor ethyl
chlorida.
CH2=CH2 + RCOCl ↔RCOCH2CH2Cl
Reaksi ethylene dengan halogen pada temperature rendah
akan menghasilkan dihaloethana, reaksi dengan chlorin lebih cepat daripada
reaksi dengan bromida dan iodida.
CH2=CH2
+ Cl2 ↔CH2ClCH2Cl
CH2=CH2
+ Br2 ↔CH2BrCH2Br
CH2=CH2
+ I2 ↔CH2ICH2I
i.
Propylene
a.
Sifat-sifat Fisis
b.
Sifat Kimia
1.
Reaksi
Disproporsionasi dengan Olefin lain
Propylene dengan katalis disproporsionasi bisa juga
bereaksi dengan olefin lain (hasil disproporsionasi antar molekul - molekul
propylene sendiri) membentuk senyawa yamg lebih panjang rantai karbonnya.
C3H6
+ C4H8-1 ↔ C5H10-2 + C2H4
C3H6
+ C5H10-2 ↔ C6H12 + C2H4
(Kirk
Othmer,1996)
2.
Reaksi
Oksidasi Katalitik
Propylene 5%
bisa dioksidasi selektif dengan udara atau steam menjadi akrolein dengan
katalis Co Molybdat atau Telurrium oksida pada 385°C.
C3H6 + O2 CH2CHCHO + H2O
Dengan kondisi yang sama, tetapi tanpa adanya
telurrium, oksidasi akan dilanjutkan menjadi asamn akrilat. Oksidasi propylene
menjadi alyl acetat akan terjadi jika umpan berupa 50% propylene, 25% oksigen dan 25% asam asetat dilewatkan pada
katalis paladium alumina pada suhu 140°C.
3. Reaksi
Polimerisasi
Propylene dengan adanya BF3 di bawah tekanan tinggi
pada temperature kamar akan terpolimerisasi.
n
C3H6 ↔ (C3H5) n
4. Reaksi dengan
HCl
Reaksi antara
propylene dengan HCl akan naik dengan naiknya temperatur dalam fase liquid.
C3H6
+ HCl ↔C3H7
Atau dapat terbentuk isopropil chloride, hexyl
chloride, dan senyawa lain.
3C3H6
+ HCl ↔C3H7Cl + C6H13Cl
5. Reaksi dengan
HF
HF dibawah tekanan akan bereaksi dengan propylene
membentuk propyl fluoride. Yield antara 60-62% pada
perbandingan mol dari 1,08 – 3,20 HF : 1 C3H6 dan pada temperatur 0 - 45°C
dengan waktu reaksi 2 – 5 jam.
C3H6
+ HF ↔C3H7F
6. Reaksi dengan
H2Cr2O7
Propylene dioksidasi
oleh larutan asam bikromat menjadi asam propionat, aseton, dan asam asetat.
CH3CHCH2
+ H2O ↔CH3CH2CH2OH
CH3CHCH2 + O2 ↔CH3CH2COOH + H2O
CH3CHCH2
+ H2O ↔CH3CHOCH3
CH3CHCH2
+ O2 ↔CH3COCH3 + H2O
7. Reaksi dengan
H2SO4
Propylene sebagian
diabsorbsi oleh H2SO4 sedangkan ethylene
tidak.
C3H6 + H2SO4 ↔C3H7 H2SO4
i. Butena
Salah satu senyawa butena adalah 2-butene yang merupakan bahan baku berbagai produk turunannya, diantaranya yaitu polybutene, Linier Low Density Polyethylene (LLDPE), High Density Polyethylene (HDPE), butadiene, MTBE, dan lain-lain.
Kegunaan polietilena antara lain untuk :
a. Isolasi atau bahan pelapis pada kawat/kabel.
b. Bahan pembuatan botol.
c. Membuat barang plastik atau kantung plastik.
d. Membuat shopping bag.
e. Bahan baku pembuatan container.
f. Bahan semikonduktor.
g. Bahan pembuatan pipa.
h. Bahan pembuatan film.
i. Lain-lain
b. Bahan pembuatan botol.
c. Membuat barang plastik atau kantung plastik.
d. Membuat shopping bag.
e. Bahan baku pembuatan container.
f. Bahan semikonduktor.
g. Bahan pembuatan pipa.
h. Bahan pembuatan film.
i. Lain-lain
Pembuatan polietilena merupakan proses penggabungan gugus molekul penyusunan yang disebut molekul raksasa yang disebut polimer. Proses ini lebih dikenal dengan polimerisasi atau proses pembentukan polimer. Pada saat terjadinya polimerisasi, lengan ikatan rangkap atau atom karbon lepas kemudian bergabung dengan karbon lainnya yang juga mengalami hal yang sama. Begitu seterusnya sehingga membentuk rangkaian panjang secara molekuler.
1. Sifat–sifat Fisis
2. Sifat–sifat Kimia Butene
a) Reaksi Adisi
a) Reaksi Adisi
Kecepatan reaksi adisi masing-masing isomer berbeda-beda. Urutan kecepatan reaksi adisi elektrophilik dengan HX (H2, ROH, HCl) adalah isobuthylene >> 1-butene > 2-butene. Sedang untuk polimerisasi adalah isobuthylene >> 1-butene, cis 2-butene > trans 2-butene.
Pada reaksi ini 1-butene dan 2-butene menghasilkan derivat sec-butyl dan iso-butylene menghasilkan derivat tert-buthyl. Pada reaksi dengan bromine (brominasi) dengan adanya methanol dan asam asetat akan menghasilkan derivate bromomethoxy dan bromoaethoxy.
b) Reaksi Polimerisasi
Polimerisasi butene akan menghasilkan beberapa polimer, seperti butylelastomer, polybuthylene,polyisobuthylene. Senyawa-senyawa asam (asam Lewis dan Bronstead) dapat digunakan sebagai inisiator. asam Bronstead (asam sulfat, asam fosfat, asam dihidrofluoroborat, asam moltndat) merupakan inisiator oligomerisasi butene yang menghasilkan polimer dengan BM rendah. Sedang asam Lewis (BF3, AlCl3, AlBr3, TiCl4, SnCl4) yang kebanyakan memerlukan koinisiator (air, methanol, asam asetat, asam klorida, asam bromida, alkil halogen) dapat menghasilkan polimer dengan BM tinggi. Di samping itu bisa juga digunakan katalis padat yang mempunyai permukaan aktif bersifat asam. Kecepatan reaksi polimerisasi ditentukan dengan mengukur kombinasi inisiator dan temperature reaksi (Kirk Othmer, 1996).








 22.30
22.30
 fromesa
fromesa







 Posted in:
Posted in:
0 komentar :
Posting Komentar